肝胆膵外科
肝胆膵領域における
低侵襲手術の現況(2023年)
- 詳しくはこちら -
肝臓・胆道・膵臓・脾臓の様々な疾患を対象に治療を行っています。消化器内科、画像診断・治療科、移植外科と毎週カンファレンスを行い、患者さんそれぞれのニーズに応じた最適な治療を提供できるように努めています。加えて癌の進行度や臓器機能および全身状態に応じて、腹腔鏡手術、焼灼療法、IVRによる治療などの低侵襲治療を積極的に導入しています。
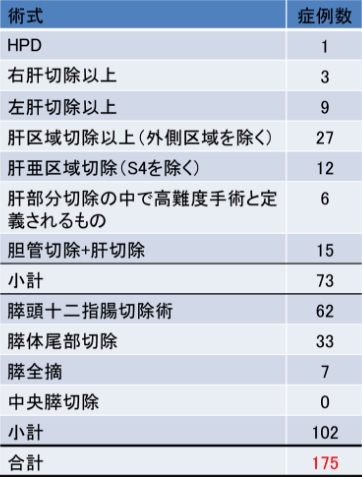
2023年に施行した肝胆膵領域の手術件数は382件であり、うち日本肝胆膵外科学会の高難度手術は合計175例とコンスタントに年間100例を越えています(図1)。2022年の肝切除数は158例(低侵襲手術103例)、膵切除数は108例(低侵襲手術68例)と、肝胆膵いずれの領域でも多くの手術を行い死亡例もありませんでした。肝胆膵外科学会高度技能専門医、内視鏡外科学会技術認定医による安全で質の高い手術と、肝臓学会指導医・胆道学会指導医・膵臓学会指導医による最先端の知識を生かした有効な治療法を提供できるように心がけております。
肝胆膵領域低侵襲手術
従来、肝胆膵外科領域は高難度な手術が多いため大開腹を余儀なくされることが多くありましたが、現在は手術技術と医療機器の進歩により急速に低侵襲手術(腹腔鏡下手術・ロボット支援下手術)が普及しています。低侵襲手術は開腹手術と比べ、傷が小さいことで術後の回復が早いだけでなく様々なメリットをもたらします。当科では日本内視鏡外科学会の内視鏡技術認定医や、肝臓・膵臓のロボット支援手術プロクターに認定された医師を中心に低侵襲手術を行っており、安全に適応を広げております(図2)。
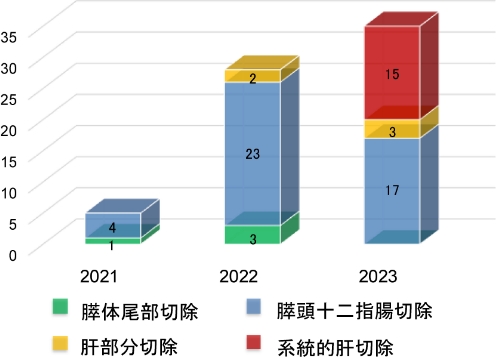
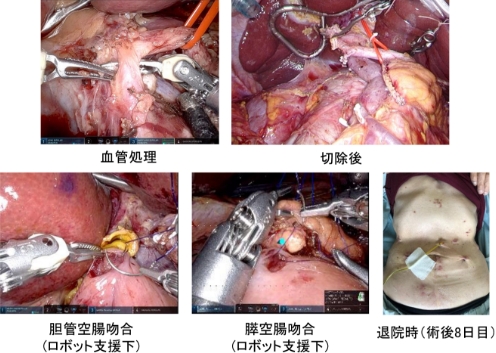
2016年より良性から低悪性度腫瘍に対する腹腔鏡下膵頭十二指腸切除術が保険収載され、当院でも2019年より本術式を積極的に導入し、現在まで90例死亡例なく安全に行ってきました。現時点の熊本県内では熊本大学病院のみが施設基準をクリアしており、その経験をもとに2022年よりロボット支援下膵頭十二指腸切除術を導入し、これまで安全に適応を拡大しております。大きな侵襲を伴う従来の開腹手術は術後のQOLやADLの低下を招きやすく、術後の抗がん剤治療や再発時の治療が入りにくいケースもありました。ロボット支援下膵頭十二指腸切除術は、傷が小さく、気腹により腸管への負担も少ないため術後の食事摂取が良好であり、術後の早期回復を可能とする上に、膵臓手術特有の合併症である膵液漏も軽減できる可能性があります。2024年3月までに44例に行い、死亡例なく術後在院日数も13日(中央値)と良好な成績を収めています。
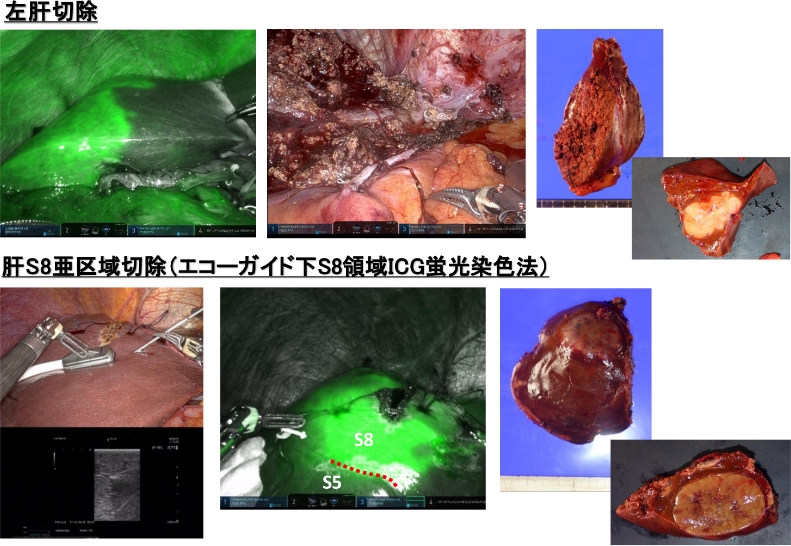
2022年よりロボット支援下肝切除術が保険収載され、同年より当院でも肝部分切除から導入を行い、2023年より系統的肝切除にも適応を拡大してきました。ロボット支援下肝切除では安定かつ、3Dを駆使した明瞭な視野のもと細緻な肝離断が可能であり、術後合併症の軽減や在院日数の短縮につながっております。もちろん従来の開腹手術と比べ、傷が非常に小さいことも大きなメリットです。2024年3月までに肝部分切除を5例、系統的肝切除を15例行い、大きな合併症や死亡例なく術後在院日数も5日(中央値)と良好な成績を収めています。
肝細胞癌
肝機能や癌の進行度を考慮して、肝切除、ラジオ波凝固療法 (RFA)、肝動脈塞栓療法(TACE)、全身薬物療法、放射線治療、肝移植などを組み合わせた『個別化治療』を行っています。他科との連携を密にしながら、熊本大学として統一した治療体系を確立しています。一方で、肝切除後予後向上のために、免疫チェックポイント阻害剤などを用いた術後補助化学療法の治験を実施しています。
肝細胞癌を含む年間肝切除数の推移を図5に示します。2005年以降の肝切除総数は2298例にのぼり、当科はコンスタントに年間100例以上の肝切除を行っている国内有数のhigh volume centerです。現在では、肝切除の6割以上を完全腹腔鏡下もしくはロボット支援下に行っています。
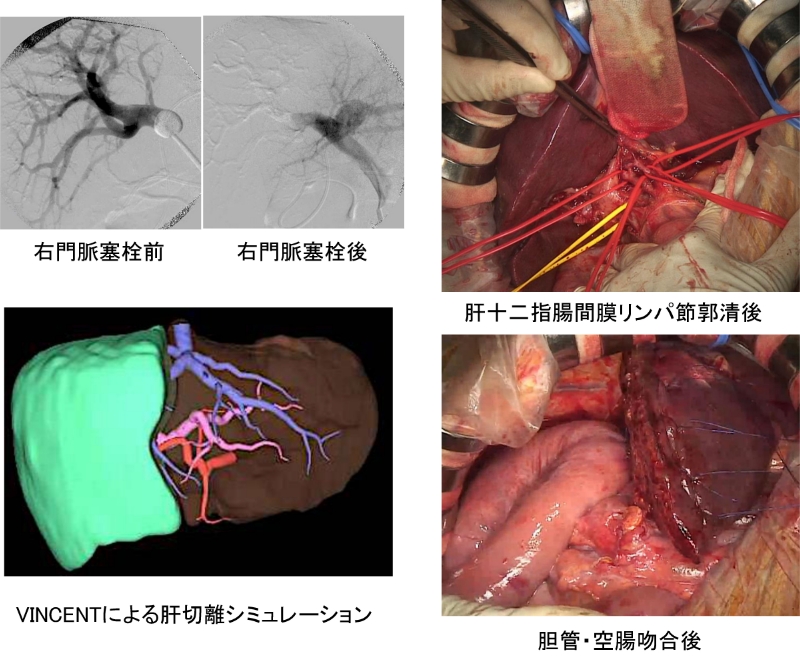
肝切除後合併症ゼロを目指して様々な取り組みを行っています。時に致命的になる術後肝不全を予防するために、VINCENTTM systemを用いた3D volumetry 画像構築による術前手術シミュレーションとアシアロSPECT/CT fusion画像を用いた「機能的」残肝容量の算出を行い、より正確な残肝評価を行っています(図6,Surgery 2015)。更にVINCENTTM systemにアシアロSPECT-CT fusion画像を融合させたアシアロSPECT-fusion VINCENTTM を用いた『機能的残肝容量に基づいた術前手術手技シミュレーション』を導入して精緻な手術を実現しています
-
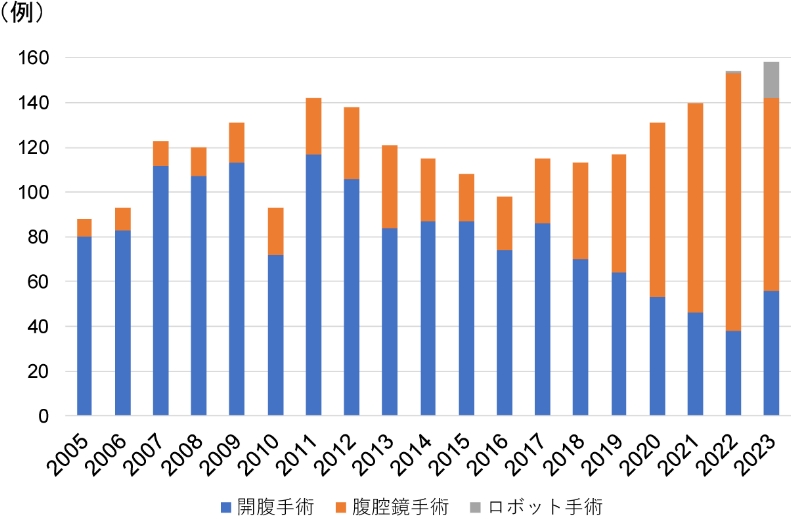
図5:肝切除数の年次推移 (n=2298) -
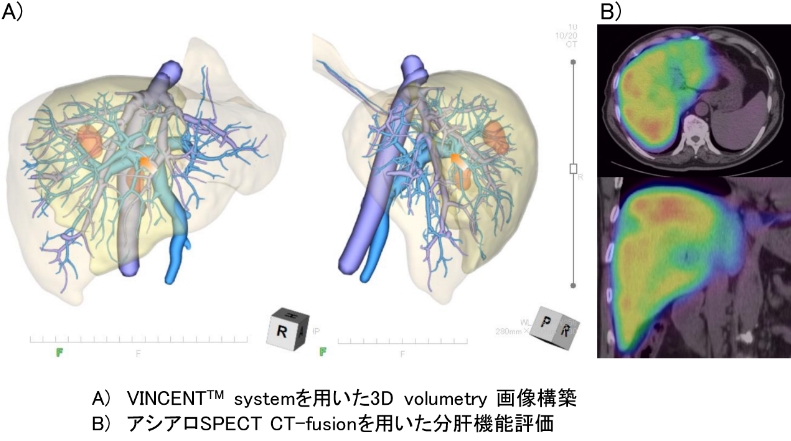
図6:機能的肝体積に基づいた術前手術手技シミュレーション
2000年から2020年までに当科で切除を行った初発肝細胞癌(n=1083)の切除後予後は、5年生存率73.2%と極めて良好です。また初発肝細胞癌に対する肝切除のstage別5年生存率も、stage Iで83.4%、stage IIで83.4%、stage IIIで61.0%、stage IVAで43.5%と、stage IIIやstage IVAの進行癌でも比較的良好な予後を実現しています。このような良好な治療成績は、再発肝細胞癌に対しても、肝機能が良好であれば、難易度が高いとされる再肝切除を積極的に行い(Liver Transplant 2015)、再発時の癌の進行度や残肝機能に応じて、RFA、TACE、分子標的治療などを組み合わせた『個別化治療』への我々の取り組みの成果と考えています(HPB 2018)。
体に優しい、創の小さな経皮的あるいは腹腔鏡手術を積極的に行っています(Surg Endosc 2019)。肝癌に対する腹腔鏡・胸腔鏡手術を全国に先駆けて1994年に導入し、現在ではICG蛍光法など術中ナビゲーションを駆使して安全性を担保しながら、区域切除や葉切除へ適応を拡大しています(図7)。小型の肝癌に対しては、RFAを選択することも可能ですのでご相談ください(Anticancer Res 2018)。
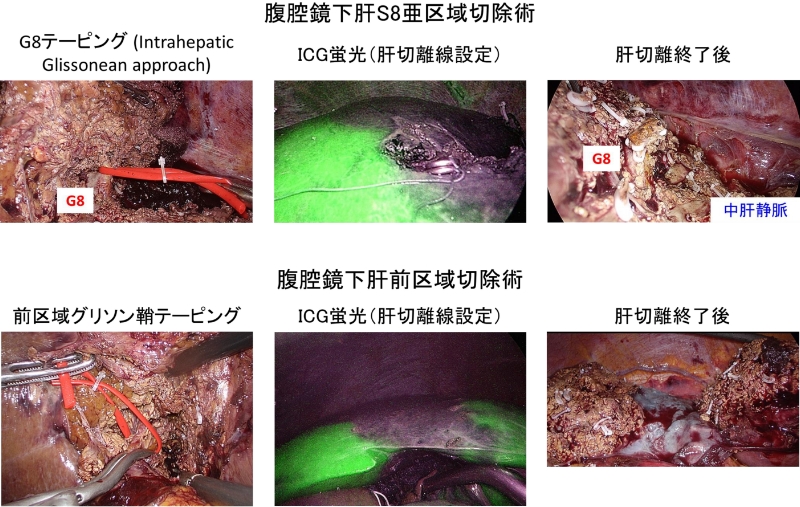
転移性肝癌
大腸癌肝転移の治療成績は、新規化学・分子標的治療の導入により急速に改善し、ガイドライン上も肝転移巣が切除可能であれば切除を行うことが推奨されています。我々は、肝切除不能な患者さんが抗癌剤治療により切除可能となれば、転移巣が10個以上など多数ある場合でも、様々な工夫をして、患者さんの予後改善のために、積極的に手術を行っています。転移巣が深部にある場合は、ラジオ波焼灼を切除に組み合わせて切除適応を拡大し(Br J Surg 2017)、転移巣が両葉にまたがる場合、切除適応拡大のために『Two-Stage hepatectomy』を積極的に行っています(Ann Surg 2015)。1st Stageで原発巣切除と残肝となる側にある腫瘍の部分切除を行い、切除予定肝葉の門脈塞栓を行います。約1ヶ月間残肝の肥大を待って、2nd Stageで門脈塞栓を行った葉を切除します(図8)。
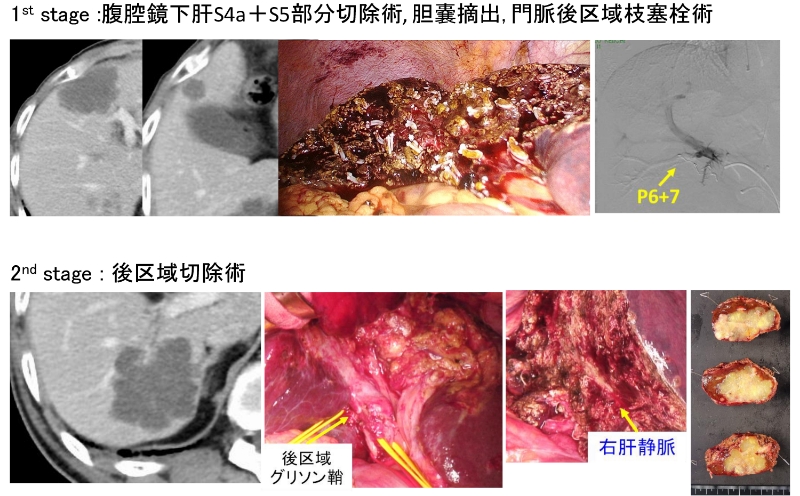
腫瘍内科医、消化器内科医、消化管外科医と連絡を密にして、肝転移巣の切除適応やタイミングを決定しています。このような工夫により、2001年から2022年までに当科で根治切除を行った大腸癌肝転移症例(n=298)の切除後5年生存率は55.5%と良好です。また、大腸癌肝転移に対しても積極的に腹腔鏡下手術を行っています。
膵癌
膵癌は極めて予後不良な難治性癌です。厚生労働省の統計では、2021年の部位別がん死亡数では男性第4位、女性第3位、男女計4位と年々増加しています。以前は手術のみが有効な治療でしたが、新しい化学療法の出現や診断技術や手術手技の向上で少しずつ治療の道が開けてきました。
2004年から2022年までに当科で切除を行った膵癌(n=329)の切除後予後は、5年生存率28.3%とまだ満足できる成績ではありません。またstage別5年生存率は、stage Iで52%、stage IIで26%、stage III/IVで0%となっており、更なる予後改善のためには、stage Iの早期に膵癌を診断すること、およびstage II/III/IVにおける術前化学療法の工夫が課題と考えています。
上腸間膜動脈や腹腔動脈など重要血管に浸潤がある局所進行癌の場合、また肝転移や腹膜播種などの遠隔転移を認める場合は、全身化学療法を行います。FOLFIRINOX療法(オキサリプラチン、イリノテカン、フルオロウラシル、レボホリナートカルシウム)かGnP療法(ゲムシタビン+ナブパクリタキセル)を個々の症例に合わせて選択しています。BRCA1/2遺伝子変異の解析やがん遺伝子パネル検査も積極的に行い、有効な治療法がないか検討しております。近年では局所進行癌で切除不能と診断された患者さんが、このような化学療法で腫瘍が縮小し、根治切除(Conversion surgery)可能となる症例も増えています(図9)。
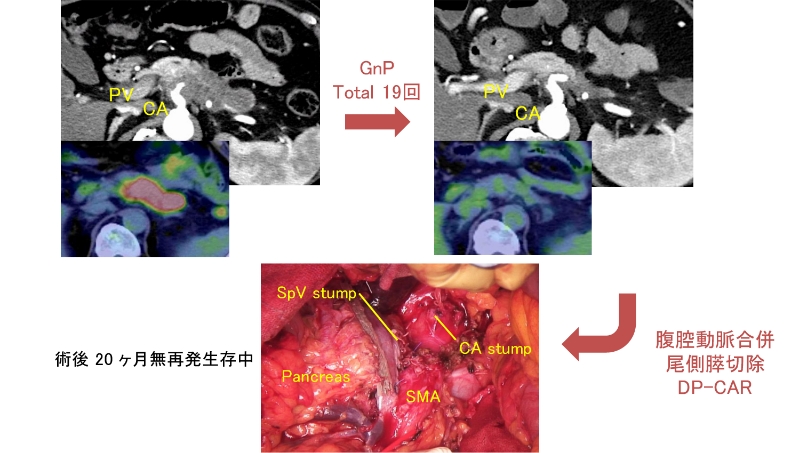
切除後予後の向上を目指して、膵癌に対しても積極的に術前化学療法を行っています。門脈浸潤を認めるなどのBorderline resectable(切除可能境界)膵癌に対してはFOLFIRINOX療法やGnP療法による術前化学療法をほぼルーチンに行っています。一方でResectable(切除可能)膵癌に対しても、Prep-02/JSAP-05試験の結果から、GS(ゲムシタビン+S-1)療法を2クール行った後に手術を行っています。
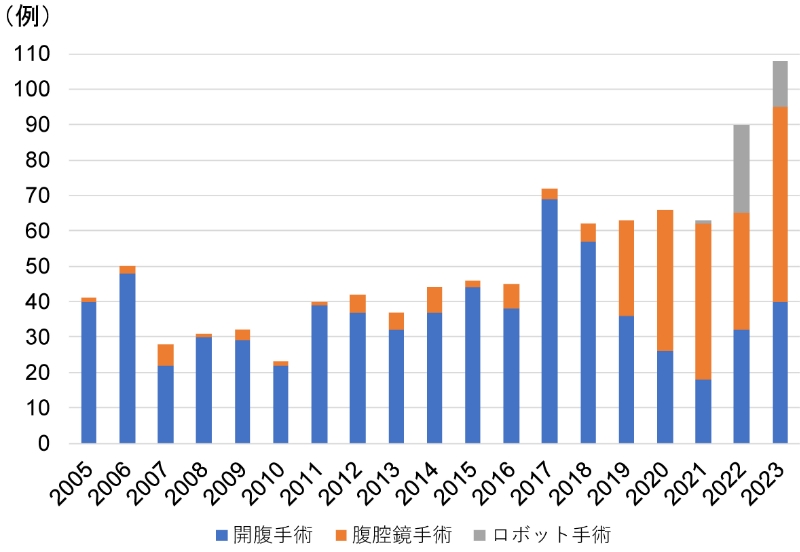
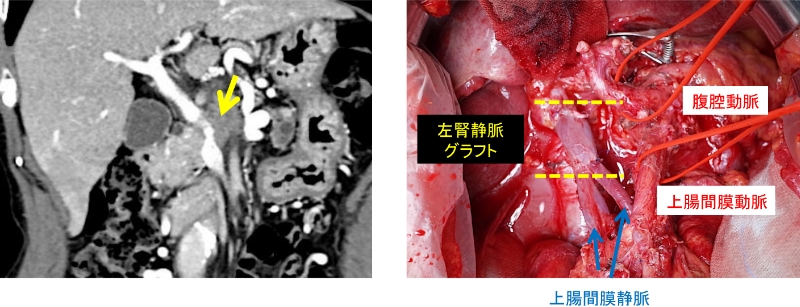
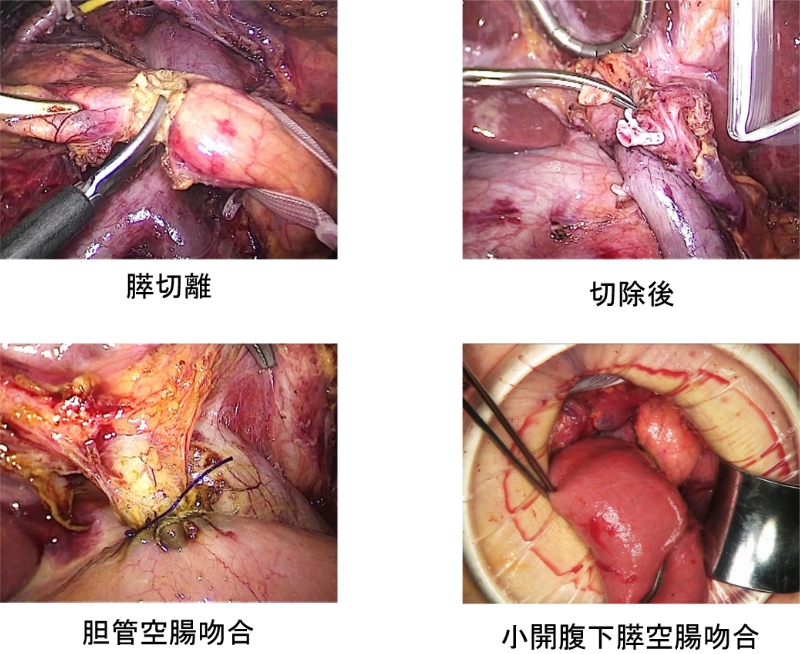
膵癌に対する手術は高侵襲で、全国的にみると合併症率が高いことから、症例数の多い施設で手術を行うことがガイドラインでも推奨されています。当科の2005年以降の膵切除の年次推移を図10に示します。当科は年間100例を超える国内有数の膵切除に関するhigh volume centerであり、現在では膵切除の6割以上を腹腔鏡下もしくはロボット支援下の低侵襲手術で行っています。局所進行癌に対しては、門脈合併切除および自家グラフトによる門脈再建を行う拡大手術を行っています(図11)。膵切除においても腹腔鏡手術の適応拡大が進み、膵神経内分泌腫瘍(PNET)といった低悪性度腫瘍のみでなく、胆管癌や膵癌に対しても腹腔鏡下膵頭十二指腸切除(図12)や腹腔鏡下尾側膵切除を行っています(図13)。現在では拡大視効果と多関節機能による精緻な手術を可能とするロボット支援下膵切除も施設基準をクリアしていますので、保険適応で手術を受けることが可能です(熊本県で唯一)。
膵神経内分泌腫瘍(PNEN)
全身の様々な臓器に分布する神経内分泌細胞から発生する腫瘍のうち、膵に発生するものが膵神経内分泌腫瘍(PNEN)です。稀な腫瘍とされており、インスリンやガストリン、グルカゴンなどのホルモン過剰分泌による症状がみられる機能性、ホルモンを分泌しない非機能性に分けられます。PNENの中には遺伝性疾患を背景としているものもあります。
治療は、原則、リンパ節郭清を伴う膵切除を行います。当科では2001年から2023年までに100例を超えるPNENの切除経験があり、最近ではほぼすべての症例で腹腔鏡下もしくはロボット支援下での膵切除を行っております。
また、PNENの悪性度やホルモン分泌等に応じて、薬物治療を組み合わせた集学的治療を行います(図14)。当院では県内唯一のNEN認定施設として、消化器外科、消化器内科、代謝内科、画像診断科による診療科横断的カンファレンスを開催し、最適な治療法を提供できるよう心がけています(図15)。


(消化器外科、消化器内科、代謝内科、画像診断科)
胆道癌
広義の胆道癌は肝内胆管癌(原発性肝癌)と肝外胆管癌(狭義の胆道癌)に分類されます。
【肝内胆管癌】 肝内胆管癌は希な原発性肝癌で、発見時既に進行している症例が多く、切除後予後が極めて不良な難治性癌です。2002年から2021年までに当科で切除を行った初発肝内胆管癌(n=104)の切除後予後は、5年生存率50.9%と比較的良好です。また初発肝内胆管癌に対する肝切除のstage別5年生存率は、stage I/IIで58.7%、stage IIIで52.6%、stage IVAで36.8%であり、更なる予後向上のためには、リンパ節転移のあるStage IVAの進行例に対する術前補助化学療法などの工夫が課題と考えています。また、肝内胆管癌再発例に対しても、適応を吟味しながら積極的に再切除を行って、良好な治療成績を収めています(Ann Gastroenterol Surg 2017)。
【狭義の胆道癌】
狭義の胆道癌は肝外胆管癌、胆嚢癌、乳頭部癌に分類されます。肝外胆管癌は、さらに胆嚢管の合流部を境に、肝臓側は肝門部領域胆管癌、膵臓側を遠位部胆管癌と分けられます。特に肝門部胆管癌は肝胆膵領域の癌の中で最も診断と治療が難しい疾患ですが、MDCTによる画像診断、血管合併切除・再建を含む拡大手術、薬物治療の進歩により胆道癌の治療成績は向上しています。2000年から2021年までに当科で切除を行った胆道癌(n=250)の切除後予後は、5年生存率42.8%と比較的良好です。また、胆道癌切除後のStage別5年生存率はstage Iで76.9%、stage II で43.8%、stage III/IVで 6.8%であり、更なる予後向上のためには、周囲脈管浸潤を伴う局所進行例やリンパ節転移を伴う胆道癌に対する集学的治療体系の確立が喫緊の課題と考えています。
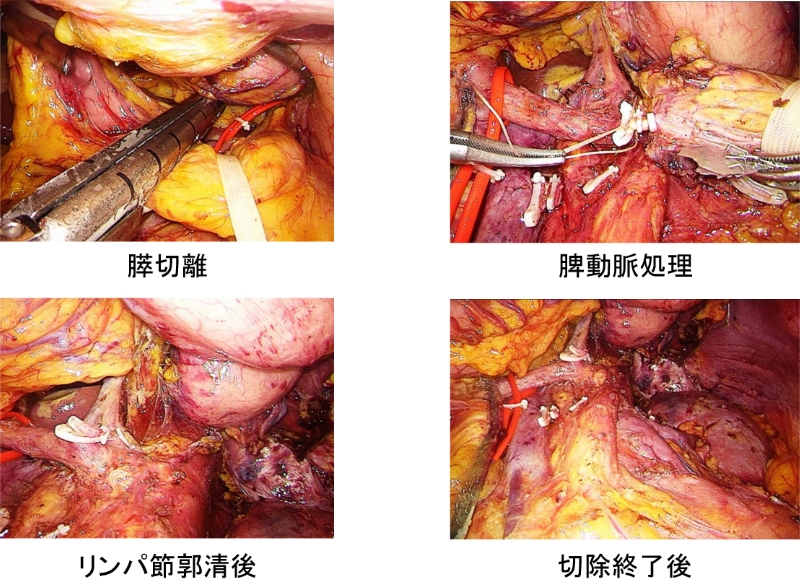
当科では、切除体積率の高い肝切除が必要な症例には、ICG試験とアシアロシンチグラフィで肝予備能を評価し、機能的肝切除率を参考に機能的残肝ICGK値を算出して手術適応を決定しています。残肝機能が不十分と思われる症例に対しては、術前に切除予定肝の門脈塞栓を行っています。残肝機能が増大した後に、右肝切除や左3区域切除術を行います(図16)。また、広範囲胆管癌に対する肝膵同時切除も積極的に行っています(図17)。
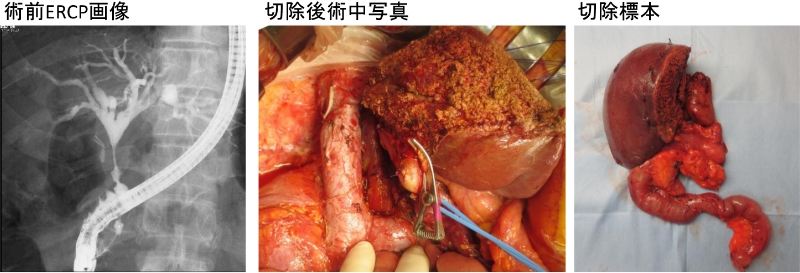
癌の浸潤範囲が更に広い切除不能症例や、肝転移など遠隔転移を伴う症例に対しては、第一選択として推奨されているゲムシタビン+シスプラチン+デュルバルマブ療法を中心に治療を行いながら、がん遺伝子パネル検査を用いた効果的な治療法の可能性も探ります。











