肝胆膵外科
肝胆膵領域における
低侵襲手術の現況(2022年)
- 詳しくはこちら -
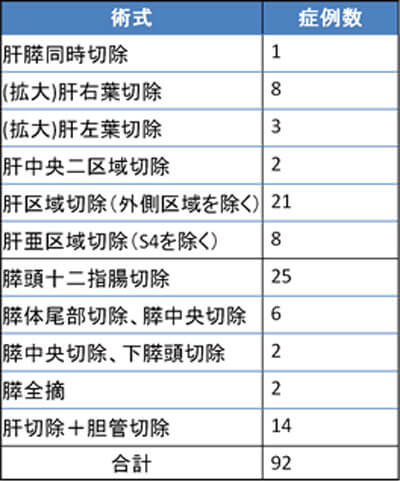
肝臓・胆道・膵臓・脾臓疾患の診断・治療を協力して行っています。消化器内科、画像診断・治療科と毎週カンファレンスを行い、患者様それぞれの病状やニーズに応じた安全かつ最適な治療を提供するよう努めています。加えて癌の進行度や肝機能、全身状態に応じて、内視鏡外科治療やIVRによる治療を積極的に導入しています。平成26年度に施行した日本肝胆膵外科学会の高難度手術は92例でした。肝胆膵いずれの領域もバランスよく手術を行っています(表1)。
肝細胞癌Hepatoma
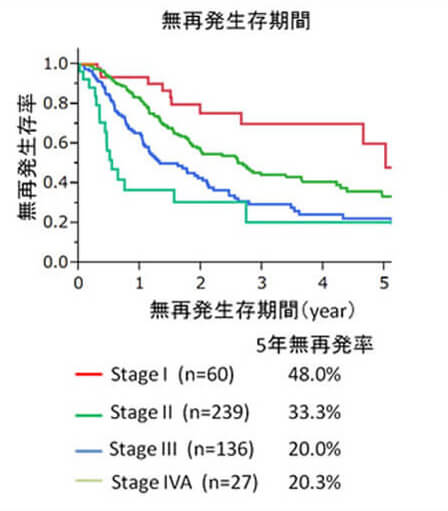
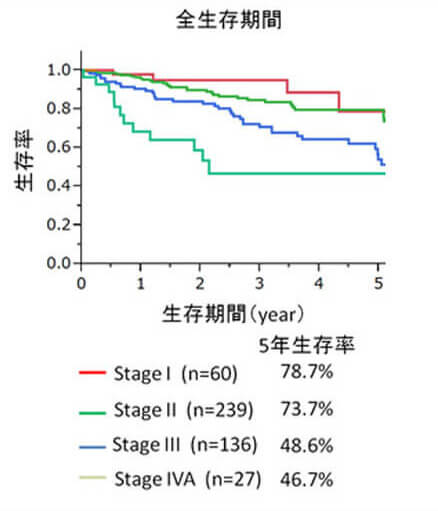
肝細胞癌の患者さんに、肝機能や進行度を考慮して、肝切除、(ラジオ波凝固療法:RFA、肝動脈・門脈塞栓療法、分子標的治療、放射線治療、肝移植などを組み合わせた『個別化集約治療』を行っ ています。他診療科と協力しながら、統一した治療体系の確立を目指しています。肝癌の入院患者数が年間300症例を超え、年間肝切除症例も100例を超える日本でも有数のhigh volume centerです。(図1, 2)。初回手術後の5年生存率)はstage Iで78.7%、stageII 73.7%、stageIII 48.6%、stageIVA 46.7%と極めて良好です。(図3)。豊富な症例の解析から、肝細胞癌切除後の新しい予後因子として、CD44Sのリガンドであるヒアルロン酸、血中亜鉛、腫瘍マーカー陽性個数、を明らかにしました(Br J Surg 2014, Ann Surg Oncol 2014, Hepatol Res 2014)。RFA治療部位再発に対する外科治療の成績を報告しました(Hepatol Res 2014)。分子標的治療薬であるソラフェニブ導入後の成績は良好で、主に外科治療の追加により3年以上の生存例も7例に増えてきています。
-
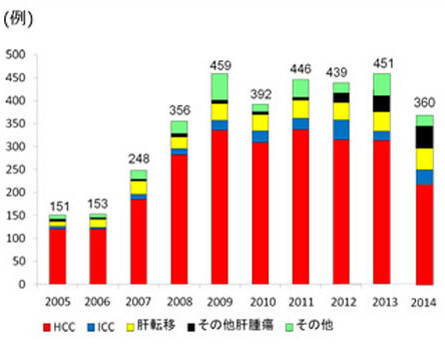
図1.肝臓Gの入院患者数の年次別推移と内訳 -
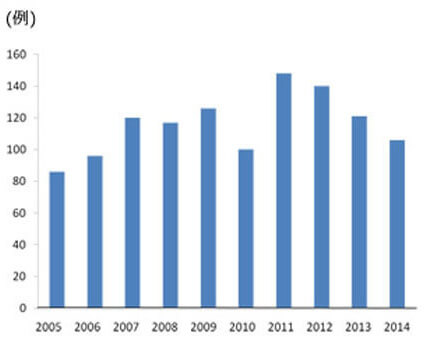
図2.肝切除数の年次別推移(n=1160)
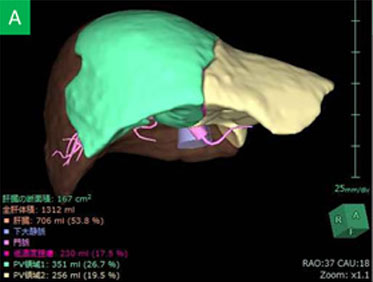
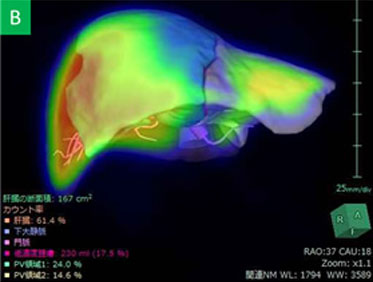
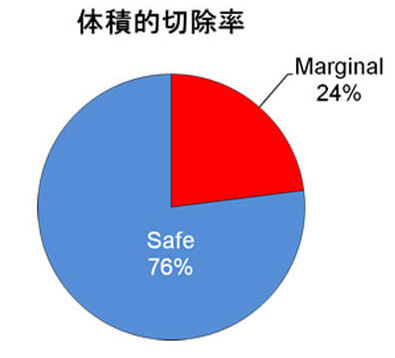
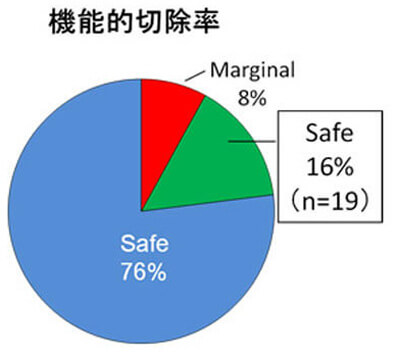
従来のCT上の体積肝切除率の検討に加えて、アシアロSPECT/CT fusionの結果をもとに機能的肝切除率の算出を行い、ICG検査と併せて、より正確な術前のリスク評価を心がけています(Nucl Med Commun 2014)。さらにVINCENTTMを用いた3D画像による『脈管解剖や肝切除範囲の確認』に加えて、最近ではVINCENTTM systemにアシアロSPECT-CT fusion画像を融合させたアシアロSPECT-fusion VINCENTTM を用いた『機能的肝体積に基づいた術前手術手技シミュレーション』を導入しています(図4)。これまでの豊富な症例数の解析により、機能的肝切除率による評価で術後の短期予後をより正確に把握でき、安全性を確保した肝切除適応の拡大が可能となりました(図5)(Surgery 2015)。B型肝炎関連肝癌には抗ウイルス療法を術前から積極的に行っています。術前から抗ウイルス療法を行うことで予後を改善することを報告しました(Anticancer Res 2015)。さらに門脈塞栓術併用肝細胞癌切除例に対するBCAA製剤による肝再生促進効果をRCTで証明しました(J Gastroenterol 2015)。
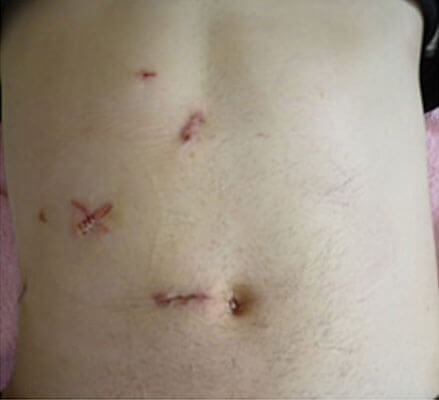
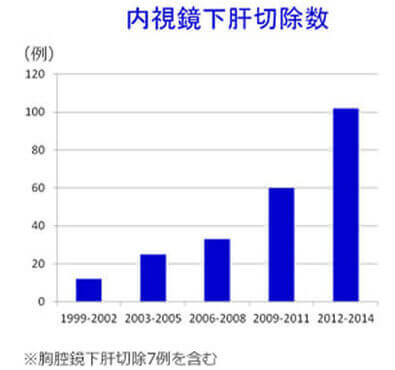
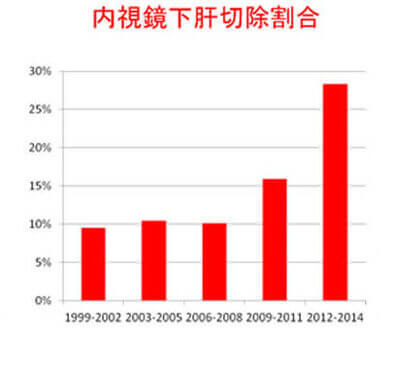
肝機能の低下した患者様には体に優しい、創の小さな経皮的あるいは鏡視下手術を積極的に行っています(図6)。肝癌に対する腹腔鏡、胸腔鏡手術を全国に先駆けて1994年に導入し、保険診療に沿って行っています。特に完全鏡視下肝切除は年々増加傾向を示しています(図7)。また開腹肝切除と比較し出血量が少なく在院日数も少ないことをpropensity matching解析で立証しました(Anticancer Res 2015)。さらに2013年7月からは腹腔鏡用造影超音波装置(ALOKA社、Prosound F75)を導入し、術中に腹腔鏡下造影超音波を行うことで、より低侵襲で正確な腹腔鏡肝切除を目指しています(図8)。担癌グリソン鞘のRFA後に造影エコーで同定した領域を切除する新しい腹腔鏡下肝切除術式を開発しました(Asian J Endosc Surg 2014)。 表在型の小型肝細胞癌に対する鏡視下RFAの成績は極めて良好で、開腹超音波と治療部位再発率8%、10年累積生存率45%でした(Hepatol Res 2013)。さらに70歳以上の高齢者に対するRFAの成績が若年者と同等であることを報告しました(Anticancer Res 2015)。
転移性肝癌Metastatic Liver Cancer
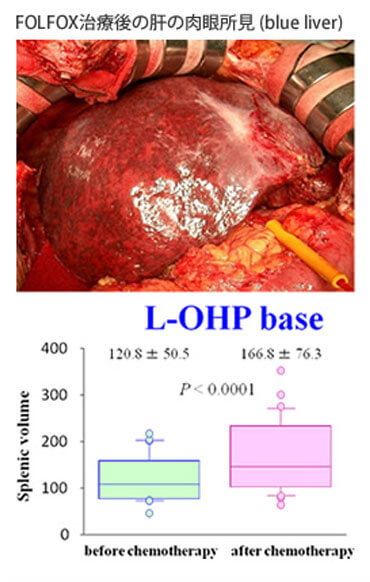
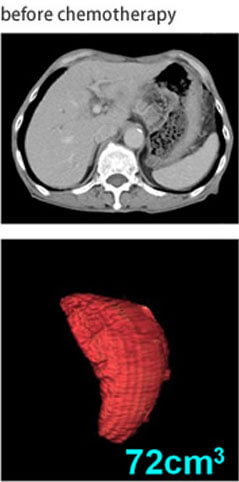
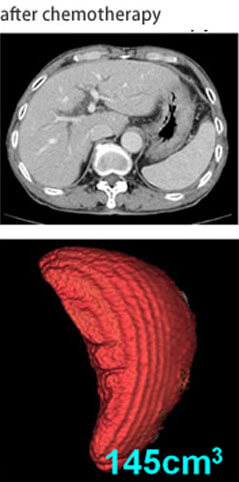
大腸癌肝転移の治療成績は肝切除と新規化学・分子標的治療の導入により、急速に改善しています。全身化学療法に分子標的治療薬を加えたレジメンが標準治療とされ、肝転移巣が切除可能となれば切除を行うことが推奨されています。導入化学療法により、切除不能大腸癌肝転移症例の40%が切除可能となり、『肝切除可能となること』が予後因子であること、さらには『肝切除可能になる条件』を明らかにしました(Ann Surg Oncol 2014)。九州地区の多施設共同試験として行ったH2、H3大腸癌肝転移に対するFOLFOX+bevacizumabによる術前化学療法後肝切除のPhase II試験(KSCC0802)の最終結果を報告しました(Anticancer Res 2014)。大腸グループと協力して、同時性大腸癌肝転移の原発巣と肝転移巣の腹腔鏡下同時切除をすでに20例以上行っています(Hepato-Gastroenterol, in press)。導入化学療法後に肝切除を行った大腸癌肝転移例の予後因子として、肝切除前のCEA、CA19-9値が重要なことをあきらかにしました(Anticancer Res 2015)。KSCCの症例との合同解析で、脾臓体積がOxaliplatinによる類洞障害予測のバイオマーカーであることを報告しました(図9)(Eur J Surg Oncol 2014)。日本肝胆膵外科学会の内視鏡外科プロジェクトでは、全国32施設から大腸癌肝転移1,331例を集積し、propensity matching解析を行いました。その結果、開腹肝切除と比較して腹腔鏡下肝切除において出血量が少なく、在院日数が短いことを証明しました(J Hepatobiliary Pancreat Sci、2015)。
脾臓疾患Splenic Disease
脾機能亢進症、特発性血小板減少性紫斑病を中心に、腹腔鏡下脾臓摘除術を積極的に行っています。1.5kgぐらいまでの脾臓はハンドアシストを併用した腹腔鏡下摘除が可能です。最近では胃静脈瘤に 対するHassab手術もハンドアシストを併用した腹腔鏡下に行っています。肝細胞癌合併例では腹腔鏡下に肝切除と摘脾術を同時に行っています。脾機能亢進症に対しては部分的脾臓塞栓術も施行しており、脾臓体積が大きい症例では、長期的な肝機能の改善が良好なことを報告しました(J Hepatobiliary Pancreat Sci 2014)。
膵癌Pancreatic Cancer
厚生労働省の統計による日本における膵臓癌死亡者数は2009年では26791人であり、癌死亡順位で男性では5位,女性では6位と年々増加傾向にあります。外科的切除が唯一の根治治療ですが、初診時にはすでに進行していることが多く、手術不能となる場合も稀ではありません。膵癌の予後は依然として悪く、治療が困難な癌の一つです。当科では手術適応を適切に決めるために、血管造影下CT(門脈造影下CT+肝動脈造影下CT)、造影剤プリモビストを用いた造影MRI(EOB-MRI)、審査腹腔鏡を用いて遠隔転移の有無を診断しています。また、腹腔内血管の3DCT像を構築して、正確で安全な手術を行うための情報として役立てています。再発症例及び合併症症例に対しては最新の知見に基づいて積極的に治療を行っています。
安全な手術を目指して
膵癌に対する標準手術は、膵頭十二指腸切除術または膵体尾部切除術です。いずれも高侵襲で合併症率が高いことから、症例数の多いhigh volume centerでの手術が推奨されています。当科では膵切除術症例が年々増加しており、年間40例前後の手術を行っています(図10,11)。私たちは症例毎に手術の振り返りを行い、安全な手術手技の定型化に努めています。また手術後の合併症に対しては、チーム内でのディスカッションを毎日行うことで、最適な治療を選択し、患者さんが一日も早く日常生活に復帰できるように努めています。
-
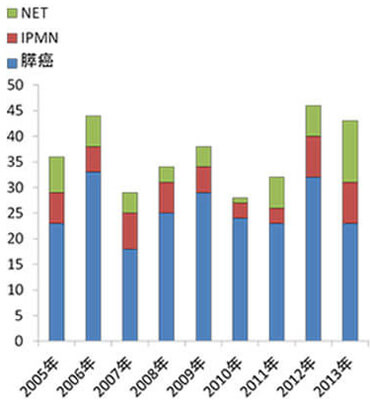
図10.膵臓疾患の入院患者数の年次別推移 -
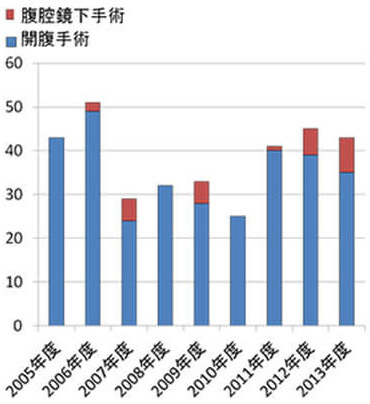
図11.膵臓切除術の年次別推移
膵腫瘍に対する縮小手術および腹腔鏡手術
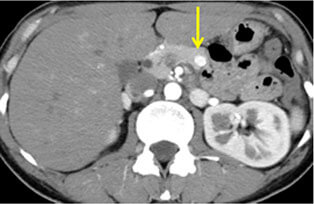
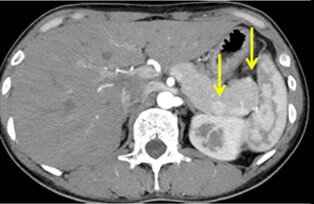
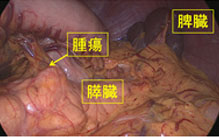
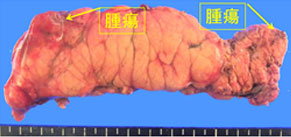
神経内分泌腫瘍(neuroendocrine tumor; 以下NET)は膵・消化管に発生する比較的稀な腫瘍で、良性から悪性まで多様な臨床像を示します。平成26年NETに関する診療ガイドライン第1版が作成されました。このガイドラインにしたがって当科では、膵体尾部の良性の膵神経内分泌腫瘍(PNET)および低悪性度腫瘍に対しては、完全腹腔鏡下膵体尾部切除術や完全腹腔鏡下核出術を行っています(図12,13)。腹腔鏡下手術は通常の開腹手術と比較して出血量が少なく、また合併症も増加していないことから安全性の高い手術と言えます。また整容性に優れるほか、手術後の痛みが軽いことから早期離床に有利であり、結果的に早期の退院が可能となります。このほか、膵頭部領域の良性疾患に対しては、十二指腸温存膵頭切除術などの縮小手術を行っています(図14,15)。
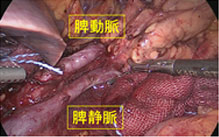
-
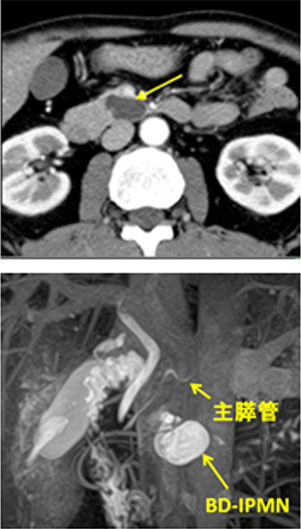
図14.十二指腸温存膵頭切除術 -
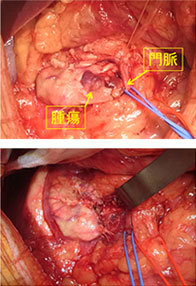
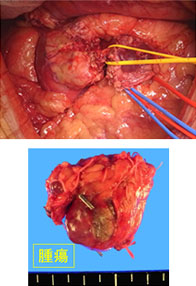
図15.十二指腸温存膵頭切除術
化学療法について
ジェムザールが本邦で保険適応承認を得てから10年が経過しました。その間にS-1という有力な新規薬剤も保険承認を得ました。JASPAC-01試験の結果から、膵癌の術後補助化学療法としてS-1単独療法を行うことが推奨されています。他の癌腫と比較して、膵癌の治療成績はまだまだ満足できるものではありませんが,治癒切除不能な膵癌に対しては化学療法がもっとも有効な治療であり、最新の知見をもって治療を行うように努めています。FOLFIRINOX 療法(オキサリプラチン、イリノテカン、フルオロウラシル、レボホリナートカルシウム)のジェムザール療法に対する優越性が証明され、2013年12月に治癒切除不能な膵癌に対し承認が得られました。また、アブラキサン・ジェムザール併用療法のジェムザール単独療法に対する優越性も証明され、2014年12月に同様に承認が得られました。これらの薬剤を通じて、さらなる膵癌の予後改善に努めたいと思います。
胆道癌Biliary tract cancer
肝門部胆管癌
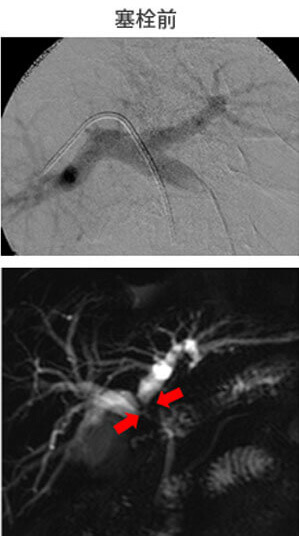
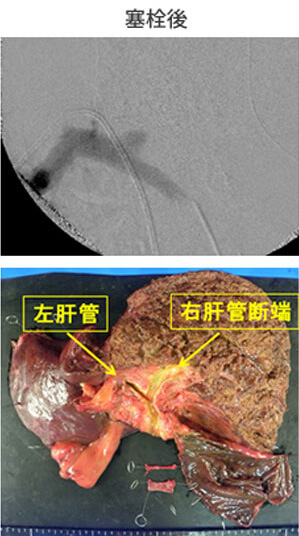
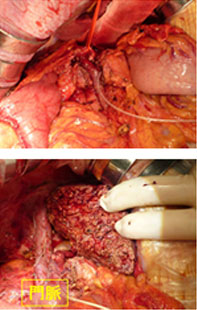
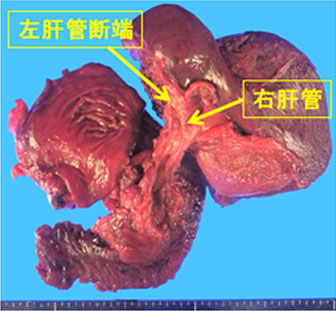
2014年10月に胆道癌診療ガイドラインが改訂されました。胆道癌は胆管癌、胆嚢癌、乳頭部癌に分類されます。とりわけ肝門部胆管癌は、胆膵領域の癌の中でももっとも診断と治療が難しい疾患です。しかし画像診断、外科治療、薬物治療の進歩により治療成績は向上しています。当科では、切除体積率の高い肝切除を必要とする症例には、アシアロシンチグラフィで肝予備能を評価し、残存肝の予備能を高め、安全な手術を行うために、術前に門脈塞栓術を行っています。門脈塞栓術から約5週間後にアシアロシンチグラフィで肝予備能を再評価し、肝左3区域切除術や肝右3区域切除術を行います(図16)。広範囲胆管癌に対しては肝切除とPDを同時に行う「HPD」を行っています(図17)。また非手術症例には、放射線治療と化学療法を併せた集学的治療を行っています。